Isomerism
रासायनिक यौगिकों का जब सूक्ष्मता से अध्ययन किया गया, तब देखा गया कि यौगिकों के गुण उनके संगठन पर निर्भर करते हैं। जिन यौगिकों के गुण एक से होते हैं उनके संगठन भी एक से ही होते हैं और जिनके गुण भिन्न होते हैं उनके संगठन भी भिन्न होते हैं। बाद में पाया गया कि कुछ ऐसे यौगिक भी हैं जिनके संगठन, अणुभार तथा अणु-अवयव एक होते हुए भी, उनके गुणों में विभिन्नता है। ऐसे विशिष्टता यौगिकों को समावयवी (Isomer, Isomeride) संज्ञा दी गई और इस तथ्य का नाम समावयवता (Isomerism) रखा गया।
Types of isomerism
समावयवता प्रधानतया दो प्रकार की होती है :
1. संरचना समावयवता (Structural isomerism)
2. त्रिविम समावयवता (Stereo-isomerism)
1. संरचना समावयवता (Structural isomerism)
यदि दो यौगिकों के अणुभार और अणुसूत्र एक ही हों, पर उनके गुणों में विभिन्नता हो, तो इसका यही कारण हो सकता है कि उनके अणु की संरचनाओं में विभिन्नता है। ऐसे दो सरलतम यौगिक एथिल ऐल्कोहॉल और डाइमेथिल ईथर हैं, जिनका अणुभार तथा अणुसूत्र, C2 H6 O, एक ही है, पर इनके संरचनासूत्र भिन्न हैं।
एथिल ऐल्कोहॉल में दो कार्बन परमाणु परस्पर संबद्ध होकर, हाइड्रॉक्सील समूह से संयुक्त हैं जबकि डाइमेथिल ईथर में दो कार्बन परमाणु ऑक्सीजन परमाणु द्वारा एक दूसरे से संबद्ध हैं। दोनों के गुणों में बहुत भिन्नता है। उनकी क्रिया से विभिन्नता स्पष्ट हो जाती है। एथिल ऐल्कोहॉल पर HI की क्रिया से एथिल आयोडाइड, C2 H5 I, बनता है, जबकि डाइमेथिल ईथर से मेथिल आयोडाइड, (CH3I) बनता है। अन्य अभिकर्मकों के साथ भी ऐसी भिन्न क्रियाएँ होती हैं।
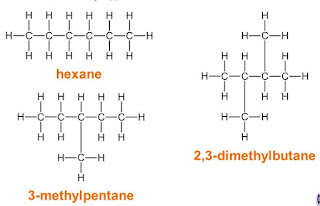
यदि ऐसे यौगिकों की समावयवता ऐसी समावयवता एक ही श्रेणी के यौगिकों के बीच हो, तो ऐसी समावयवता को मध्यावयवता (Metamerism) कहते हैं। इसका उदाहरण डाइएथिल ईथर (C2H5OC2H5) और मेथिल प्रोपिल ईथर (CH3 OC3 H7) है। पैराफिन श्रेणी के हाइड्रोकार्बनों में ऐसे अनेक उदाहरण मिलते हैं। पेंटने (C5H12) के तीन समावयव होते हैं : नार्मल पेंटेन, आइसो-पेंटेन और नियोपेंटेन।
ऐसी समावयवता को शृंखला समावयवता (Chain isomerism) भी कहते हैं, क्योंकि यहाँ शृंखला में ही अंतर होने के कारण विभिन्नता है।
इसी समावयवता से मिलती-जुलती एक दूसरी समावयवता है, जिसे स्थान-समावयवता (Position isomerism) कहते हैं, इसका सरलतम उदाहरण प्रोपिल क्लोराइड (CH3। CH2। CH2Cl) और आइसोप्रोपिल क्लोराइड (CH3। CHCl. CH3) है, जिनमें अंतर केवल क्लोरीन परमाणु के स्थान से संबंध रखता है। एक में क्लोरीन अंत के एक कार्बन परमाणु से संबद्ध है और दूसरे में क्लोरीन मध्य के कार्बन से संबद्ध है। इसी प्रकार की समावयवता डाइक्लोरोबेंज़ोन में भी है।
Structural Isomerism is of five types:-
A. Chain Isomers.
B. Position Isomers.
C. Functional Isomers.
D. Metamerism.
E. Tautomerism.
A. Chain Isomers.
चेन आइसोमर के पास एक ही आणविक सूत्र होता है लेकिन उस क्रम में भिन्न होता है जिसमें सी-परमाणु एक-दूसरे से बंधे होते हैं।
B. Position Isomers.
एक ही श्रृंखला में कार्यात्मक समूह की स्थिति में अंतर के कारण आइसोमेरिज्म को स्थिति isomerism कहा जाता है।
C. Functional Isomers.
कार्यात्मक आइसोमर के पास एक ही आणविक सूत्र होता है लेकिन विभिन्न कार्यात्मक समूह होते हैं।
D. Metamerism.
इस प्रकार का आइसोमेरिज्म कार्यात्मक समूह के दोनों ओर कार्बन परमाणुओं के असमान वितरण के कारण होता है। मेटामेरिज्म एक ही homologous श्रृंखला से संबंधित है।
E. Tautomerism.
यह एक विशेष प्रकार का कार्यात्मक आइसोमेरिज्म है जिसमें आइसोमर एक-दूसरे के साथ गतिशील संतुलन में होते हैं।
2. त्रिविम समावयवता (Stereo isomerism)
यौगिकों के अणुभार और संरचना के एक रहते हुए भी परमाणुओं के विभिन्न दिशाओं में व्यवस्थित रहने के कारण यौगिक में समावयवता हो सकती है। ऐसी समावयवता को त्रिविम समावयवता (Stereo-isomerism) कहते हैं। त्रिविम समावयवता दो प्रकार की होती है :
- (A) प्रकाशिक समावयवता (Optical isomerism) iऔर
- (B) ज्यामितीय समावयवता (Geametrical Isomerism)
A. प्रकाशिक समावयवता (Optical isomerism)
लैक्टिक अम्ल के अध्ययन में देखा गया है कि लैक्टिक अम्ल तीन प्रकार का होता है, दो प्रकाशत: सक्रिय और एक प्रकाशत: निष्क्रिय। इसी प्रकार टार्टेरिक अम्ल भी चार प्रकार का होता है, दो प्रकाशत: सक्रिय और दो प्रकाशत: निष्क्रिय। इनकी उपस्थिति की संतोषप्रद व्याख्या उस समय तक ज्ञात सिद्धांतों से नहीं हो सकती थी। इनकी व्याख्या के लिए जो सिद्धांत प्रतिपादित हुआ है, उसे त्रिविम समावयवता का सिद्धांत कहते हैं और इससे रसायन की एक नई शाखा की नींव पड़ी है, जिसे त्रिविम रसायन कहते हैं।
B. ज्यामितीय समावयवता (GeOmetrical Isomerism)
ज्यामितीय समावयवता में प्रकाश सक्रियता नहीं होती। यह समावयवता उन्हीं यौगिकों में पाई जाती है जिनमें दो कार्बन परमाणु युग्म बंध से बँधे होते हैं। यदि ऐसे यौगिकों के दोनों कार्बन परमाणुओं से एक से अधिक समूह संबद्ध हों, तो उससे निम्नलिखित प्रकार के दो यौगिक बन सकते हैं। एक, जिसमें दोनों समूह एक ही पक्ष में हैं और दूसरा, जिसमें दोनों समूह प्रतिकूल पक्ष में हैं। पहले यौगिकों को सिस (Cis) और दूसरे को ट्रैंस (Trans) कहते हैं। ऐसे यौगिकों में युग्म बंध के कारण अणु में दृढ़ता होती है, जिससे उसका मुक्त संचालन अवरुद्ध हो जाता है। ऐसे समावयव यौगिकों के सरलतम उदाहरण मलेइक और फ्यूमेरिक अम्ल हैं। मलेइक अम्ल में दोनों कार्बोक्सील समूह एक ही पक्ष में होते हैं और फ्यूमेरिक अम्ल में दोनों कार्बोक्सील समूह प्रतिकूल पक्ष में। इसकी पुष्टि इस बात से होती है कि मलेइक अम्ल अति शीघ्र ऐनहाइड्राइड बनाता है, जो कार्बोक्सील समूह की निकटता को प्रदर्शित करता है और फ्यूमेरिक अम्ल इतना जल्द ऐनहाइड्राइड नहीं बनाता, जो कार्बोक्सील समूह की दूरी को प्रदर्शित करता है। यदि ऐनहाइड्राइड कठिनता से बनता भी है, तो वह मलेइक ऐनहाइड्राइड ही होता है।
ऐसी समावयवता के लिए यह आवश्यक नहीं कि एक कार्बन परमाणु दूसरे कार्बन परमाणु के साथ ही संयुक्त हो। कार्बन यदि नाईट्रोजन के साथ संयुक्त हो, तो भी ऐसे समावयवी बनते हैं। इसके उदाहरण अनेक ऑक्सीम हैं, जो कीटोन पर हाइड्रांक्सिल ऐमीन की क्रिया से बनते हैं।






Comments
Post a Comment